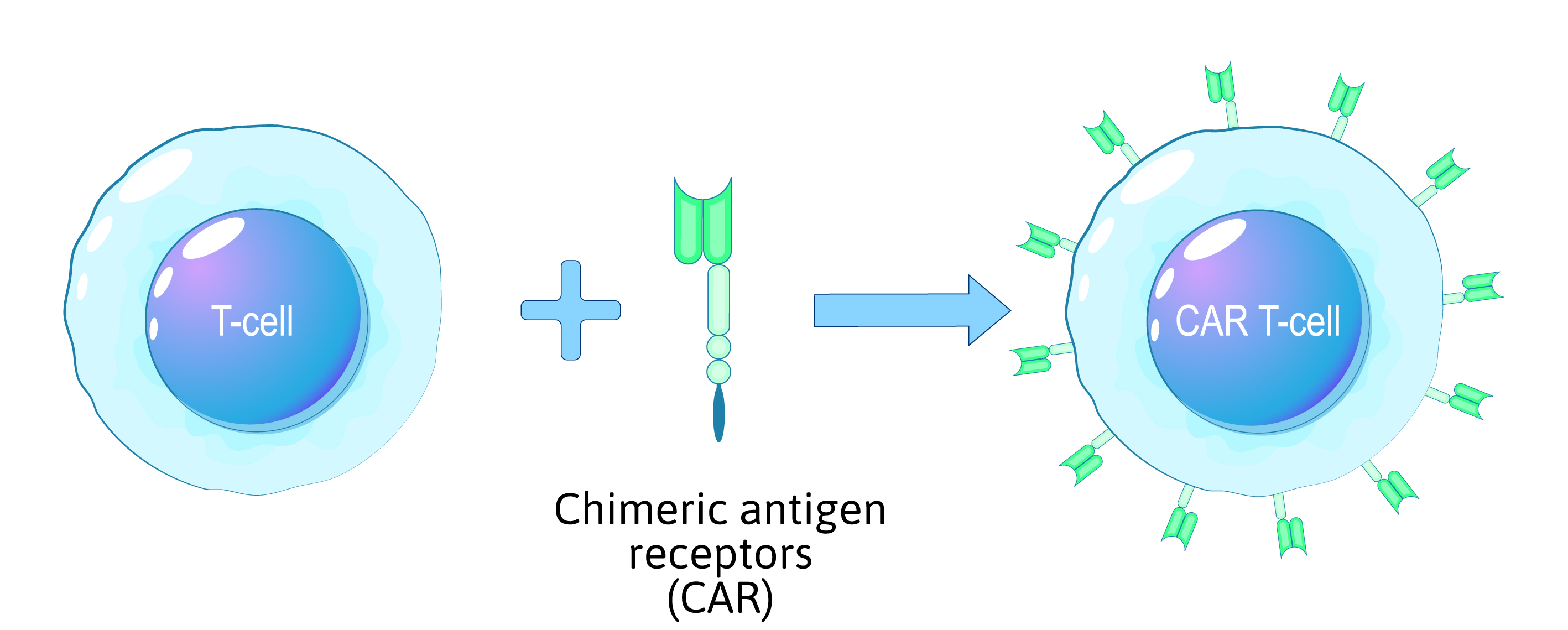
La terapia con cellule T CAR, un approccio innovativo al trattamento di alcuni tipi di cancro, si basa sulla modifica genetica delle cellule immunitarie del paziente per colpire e distruggere le cellule tumorali. Questo complesso processo richiede procedure di laboratorio altamente specializzate ed è essenziale dare priorità alla sicurezza delle cellule modificate, del paziente e degli operatori sanitari coinvolti.
Questo articolo approfondisce il processo di modificazione genetica delle cellule CAR T, il ruolo cruciale del controllo della contaminazione e il ruolo fondamentale dei dispositivi di protezione individuale (DPI) nel mantenere un ambiente sicuro.
Il processo di modifica genetica delle cellule CAR T
-
Raccolta di cellule T:
- Il processo di terapia con cellule CAR T inizia con la raccolta delle cellule T del paziente attraverso la leucaferesi, una procedura simile alla donazione di sangue.
- La leucaferesi separa i linfociti T dagli altri componenti del sangue, garantendo un'elevata concentrazione di cellule bersaglio.
- Garantire un ambiente di raccolta pulito e sterile è essenziale per evitare la contaminazione, poiché qualsiasi compromissione all'inizio del processo può influire sull'efficacia della terapia.
-
Isolamento e attivazione:
- Una volta raccolte, le cellule T vengono isolate e attivate in laboratorio. Vengono quindi coltivati per garantire che siano in uno stato attivo e pronti per essere modificati.
- Una volta raccolte, le cellule T vengono isolate e attivate in laboratorio. Vengono quindi coltivati per garantire che siano in uno stato attivo e pronti per essere modificati.
-
Modifica genetica:
- La modificazione genetica è una fase cruciale del processo di produzione delle cellule CAR T. Gli scienziati introducono una nuova sequenza genetica nelle cellule T per consentire loro di esprimere il recettore dell'antigene chimerico (CAR).
- Questo CAR è progettato per riconoscere antigeni specifici presenti sulla superficie delle cellule tumorali.
- Per trasportare il gene CAR nel genoma delle cellule T si utilizzano vettori lentivirali o retrovirali. Un rigoroso controllo della contaminazione garantisce l'integrità del processo di modificazione genetica.
-
Espansione:
- Dopo la modifica genetica, le cellule T CAR vengono espanse in coltura per creare una popolazione più ampia di queste cellule immunitarie specializzate. Questa fase garantisce la presenza di un numero sufficiente di cellule CAR T per montare una risposta immunitaria efficace.
Figura 1: Panoramica del processo di riprogrammazione delle cellule T CAR mediante recettori antigenici chimerici (CAR).
- Dopo la modifica genetica, le cellule T CAR vengono espanse in coltura per creare una popolazione più ampia di queste cellule immunitarie specializzate. Questa fase garantisce la presenza di un numero sufficiente di cellule CAR T per montare una risposta immunitaria efficace.
-
Controllo qualità:
- Per garantire la sicurezza e l'efficacia dei linfociti T modificati sono state adottate rigorose misure di controllo della qualità. Ciò include la valutazione della purezza, della vitalità e della funzionalità delle cellule T CAR.
- Per garantire la sicurezza e l'efficacia dei linfociti T modificati sono state adottate rigorose misure di controllo della qualità. Ciò include la valutazione della purezza, della vitalità e della funzionalità delle cellule T CAR.
-
Infusione nel paziente:
- La fase finale prevede l'infusione delle cellule CAR T modificate nel sangue del paziente. Questa infusione segna l'inizio della fase terapeutica, in cui le cellule T CAR riconoscono e attaccano le cellule tumorali con l'antigene bersaglio.
- La fase finale prevede l'infusione delle cellule CAR T modificate nel sangue del paziente. Questa infusione segna l'inizio della fase terapeutica, in cui le cellule T CAR riconoscono e attaccano le cellule tumorali con l'antigene bersaglio.
Misure di controllo della contaminazione
Un efficace controllo della contaminazione è indispensabile durante tutto il processo di modificazione genetica delle cellule CAR T per mantenere l'integrità della terapia e garantire la sicurezza dei pazienti e del personale di laboratorio. Le principali misure di controllo della contaminazione includono:
-
Tecniche sterili: Il personale di laboratorio deve attenersi rigorosamente alle tecniche sterili, tra cui lavaggio delle mani, camice e guanti, per garantire che tutte le attrezzature e i materiali utilizzati siano sterili.
-
Cabine di sicurezza biologica (BSC): La modificazione genetica delle cellule avviene all'interno di cabine di sicurezza biologica di Classe II, che forniscono un ambiente controllato e sterile. Questi armadi aiutano a contenere i potenziali contaminanti e a proteggere i lavoratori del laboratorio.
-
Strutture della camera bianca: La produzione di cellule T CAR avviene spesso in strutture di classe ISO, progettate specificamente per mantenere elevati livelli di pulizia e controllare la contaminazione da particolato.
-
Barriere di isolamento: Le barriere fisiche di isolamento, come le cappe a flusso laminare e i sistemi chiusi, sono utilizzate per prevenire la contaminazione durante i processi di manipolazione e coltura delle cellule.
-
Monitoraggio di routine: Il monitoraggio regolare degli ambienti di laboratorio per la qualità dell'aria, la contaminazione delle superfici e la presenza di microbi è essenziale per identificare e affrontare tempestivamente le potenziali fonti di contaminazione. Gli strumenti di monitoraggio più comuni includono contatori di particelle e campionatori microbici.
-
Smaltimento dei rifiuti: lo smaltimento corretto dei materiali di scarto, comprese le attrezzature potenzialmente contaminate e i rifiuti biologici, è fondamentale per evitare la contaminazione. Lo smaltimento dei materiali contaminati, compresi quelli taglienti, è fondamentale per prevenire qualsiasi esposizione accidentale del personale.